Как определить четная или нечетная функция. Свойства функций. Алгоритм исследования функции на чётность
1. Среди всех известных реакций различают реакции обратимые и необратимые. При изучении реакций ионного обмена были перечислены условия, при которых они протекают до конца. ().
Известны и такие реакции, которые при данных условиях до конца не идут. Так, например, при растворении в воде сернистого газа происходит реакция: SO 2 +H 2 O → H 2 SO 3 . Но оказывается, что в водном растворе может образоваться только определенное количество сернистой кислоты. Это объясняется тем, что сернистая кислота непрочная, и происходит обратная реакция, т.е. разложение на оксид серы и воду. Следовательно, данная реакция не идет до конца потому, что одновременно происходит две реакции – прямая (между оксидом серы и водой) и обратная (разложение сернистой кислоты). SO 2 +H 2 O ↔ H 2 SO 3 .
Химические реакции, протекающие при данных
условиях во взаимно противоположных направлениях, называются обратимыми.
2. Поскольку скорость химических реакций зависит от концентрации реагирующих веществ, то вначале скорость прямой реакции(υ пр ) должна быть максимальной,а скорость обратной реакции (υ обр ) равняется нулю. Концентрация реагирующих веществ с течением времени уменьшается, а концентрация продуктов реакции увеличивается. Поэтому скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается. В определенный момент времени скорость прямой и обратной реакций становятся равными:
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия:
υ пр = υ обр
Состояние системы, при котором скорость прямой реакции равна скорости обратной реакции, называют химическим равновесием.
В состоянии химического равновесия количественное соотношение между реагирующими веществами и продуктами реакции остается постоянным: сколько молекул продукта реакции в единицу времени образуется, столько их и разлагается. Однако состояние химического равновесия сохраняется до тех пор, пока остаются неизменными условия реакции: концентрация, температура и давление.
Количественно состояние химического равновесия описывается законом действующих масс.
При равновесии отношение произведения концентраций продуктов реакции (в степенях их коэффициентов) к произведению концентраций реагентов (тоже в степенях их коэффициентов) есть величина постоянная, не зависящая от исходных концентраций веществ в реакционной смеси.
Эта постоянная величина называется константой равновесия - k
Так для реакции: N 2 (Г) + 3 H 2 (Г) ↔ 2 NH 3 (Г) + 92,4 кДжконстанта равновесия выражается так:
υ 1 = υ 2
υ 1 (прямой реакции) = k 1 [ N 2 ][ H 2 ] 3 , где – равновесные молярные концентрации, = моль/л
υ 2 (обратной реакции) = k 2 [ NH 3 ] 2
k 1 [ N 2 ][ H 2 ] 3 = k 2 [ NH 3 ] 2
K p = k 1 / k 2 = [ NH 3 ] 2 / [ N 2 ][ H 2 ] 3 – константа равновесия .
Химическое равновесие зависит – от концентрации, давления, температуры.
Принцип определяет направление смешения равновесия:
Если на систему, находящуюся в равновесии оказали внешнее воздействие, то равновесие в системе сместится в сторону обратную этому воздействию.
1) Влияние концентрации – если увеличить концентрацию исходных веществ, то равновесие смещается в сторону образования продуктов реакции.
Например, K p = k 1 / k 2 = [ NH 3 ] 2 / [ N 2 ][ H 2 ] 3
При добавлении в реакционную смесь, например азота , т.е. возрастает концентрация реагента, знаменатель в выражении для К увеличивается, но так как К – константа, то для выполнения этого условия должен увеличиться и числитель. Таким образом, в реакционной смеси возрастает количество продукта реакции. В таком случае говорят о смещении химического равновесия вправо, в сторону продукта.
Таким образом, увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции. Увеличение концентрации продуктов (жидких или газообразных) смещает равновесие в сторону реагентов, т.е. в сторону обратной реакции.
Изменение массы твердого вещества не изменяет положение равновесия.
2) Влияние температуры – увеличение температуры смещает равновесие в сторону эндотермической реакции.
а) N 2 (Г) + 3 H 2 (Г) ↔ 2 NH 3 (Г) + 92,4 кДж (экзотермическая – выделение тепла)
При повышении температуры равновесие сместится в сторону реакции разложения аммиака (←)
б) N 2 (Г) + O 2 (Г) ↔ 2 NO (Г) – 180,8 кДж(эндотермическая -поглощение тепла)
При повышении температуры равновесие сместится в сторону реакции образования NO (→)
3) Влияние давления (только для газообразных веществ) – при увеличении давления, равновесие смещается в сторону образовани я веществ, занимающих меньший о б ъ ём.
N 2 (Г) + 3 H 2 (Г) ↔ 2 NH 3 (Г)
1 V - N 2
3 V - H 2
2 V – NH 3
При повышении давления ( P ): до реакции 4 V газообразных веществ → после реакции 2 V газообразных веществ, следовательно, равновесие смещается вправо ( → )
При увеличении давления, например, в 2 раза, объём газов уменьшается в такое же количество раз, а следовательно, концентрации всех газообразных веществ возрастут в 2 раза. K p = k 1 / k 2 = [ NH 3 ] 2 / [ N 2 ][ H 2 ] 3
В этом случае числитель выражения для К увеличится в 4 раза, а знаменатель в 16 раз, т.е. равенство нарушится. Для его восстановления должны возрасти концентрация аммиака и уменьшиться концентрации азота и водо рода. Равновесие сместится вправо.
Итак, при повышении давления равновесие смещается в сторону уменьшения объема, при понижении давления – в сторону увеличения объёма.
Изменение давления практически не сказывается на объёме твердых и жидких веществ, т.е. не изменяет их концентрацию. Следовательно, равновесие реакций, в которых газы не участвуют, практически не зависит от давления.
! На течение химической реакции влияют вещества – катализаторы. Но при использовании катализатора понижается энергия активации как прямой, так и обратной реакции на одну и ту же величину и поэтому равновесие не смещается.
Решите задачи:
№1. Исходные концентрации СO и O 2 в обратимой реакции
2CO (г) + O 2 (г)↔ 2 CO 2 (г)
Равны соответственно 6 и 4 моль/л. Вычислите константу равновесия, если концентрация CO 2 в момент равновесия равна 2 моль/л.
№2. Реакция протекает по уравнению
2SO 2 (г) + O 2 (г) = 2SO 3 (г) + Q
Укажите, куда сместится равновесие, если
а) увеличить давление
б) повысить температуру
в) увеличить концентрацию кислорода
г) введение катализатора?
Если система находится в состоянии равновесия, то она будет пребывать в нем до тех пор, пока внешние условия сохраняются постоянными. Если же условия изменятся, то система выйдет из равновесия - скорости прямого и обратного процессов изменятся неодинаково - будет протекать реакция. Наибольшее значение имеют случаи нарушения равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в равновесии, давления или температуры.
Рассмотрим каждый из этих случаев.
Нарушение равновесия вследствие изменения концентрации какого-либо из веществ, участвующих в реакции. Пусть водород, иодоводород и пары иода находятся в равновесии друг с другом при определенных температуре и давлении. Введем в систему дополнительно некоторое количество водорода. Согласно закону действия масс, увеличение концентрации водорода повлечет за собой увеличение скорости прямой реакции - реакции синтеза HI, тогда как скорость обратной реакции не изменится. В прямом направлении реакция будет теперь протекать быстрее, чем в обратном. В результате этого концентрации водорода и паров иода будут уменьшаться, что повлечет за собою замедление прямой реакции, а концентрация HI будет возрастать, что вызовет ускорение обратной реакции. Через некоторое время скорости прямой и обратной реакций вновь сравняются- установится новое равновесие. Но при этом концентрация HI будет теперь выше, чем она была до добавления , а концентрация - ниже.
Процесс изменения концентраций, вызванный нарушением равновесия, называется смещением или сдвигом равновесия. Если при этом происходит увеличение концентраций веществ, стоящих в правой части уравнения (и, конечно, одновременно уменьшение концентраций веществ, стоящих слева), то говорят, что равновесие смещается вправо, т. е. в направлении течения прямой реакции; при обратном изменении концентраций говорят о смещении равновесия влево - в направлении обратной реакции. В рассмотренном примере равновесие сместилось вправо. При этом то вещество , увеличение концентрации которого вызвало нарушение равновесия, вступило в реакцию - его концентрация понизилась.
Таким образом, при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества; при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Нарушение равновесия вследствие изменения давления (путем уменьшения или увеличения объема системы). Когда в реакции участвуют газы, равновесие может нарушиться при изменении объема системы.
Рассмотрим влияние давления на реакцию между монооксидом азота и кислородом:
Пусть смесь газов , и находится в химическом равновесии при определенной температуре и давлении. Не изменяя температуры, увеличим давление так, чтобы объем системы уменьшился в 2 раза. В первый момент парциальные давления и концентрации всех газов возрастут вдвое, но при этом изменится соотношение между скоростями прямой и обратной реакций - равновесие нарушится.
В самом деле, до увеличения давления концентрации газов имели равновесные значения , и , а скорости прямой и обратной реакций были одинаковы и определялись уравнениями:
В первый момент после сжатия концентрации газов увеличатся вдвое по сравнению с их исходными значениями и будут равны соответственно , и . При этом скорости прямой и обратной реакций будут определяться уравнениями:
Таким образом, в результате увеличения давления скорость прямой реакции возросла в 8 раз, а обратной - только в 4 раза. Равновесие в системе нарушится - прямая реакция будет преобладать над обратной. После того как скорости сравняются, вновь установится равновесие, но количество в системе возрастет, равновесие сместится вправо.
Нетрудно видеть, что неодинаковое изменение скоростей прямой и обратной реакций связано с тем, что в левой и в правой частях уравнения рассматриваемой реакции различно число молекул газов: одна молекула кислорода и две молекулы монооксида азота (всего три молекулы газов) превращаются в две молекулы газа - диоксида азота. Давление газа есть результат ударов его молекул о стенки сосуда; при прочих равных условиях давление газа тем выше, чем больше молекул заключено в данном объеме газа. Поэтому реакция, протекающая с увеличением числа молекул газов, приводит к возрастанию давления, а реакция, протекающая с уменьшением числа молекул газов, - к его понижению.
Помня об этом, вывод о влиянии давления на химическое равновесие можно сформулировать так:
При увеличении давления путем сжатия системы равновесие сдвигается в сторону уменьшения числа молекул газов, т. е. в сторону понижения давления, при уменьшении давления равновесие сдвигается в сторону возрастания числа молекул газов, т. е. в сторону увеличения давления.
В том случае, когда реакция протекает без изменения числа молекул газов, равновесие не нарушается при сжатии или при расширении системы. Например, в системе
равновесие не нарушается при изменении объема; выход HI не зависит от давления.
Нарушение равновесия вследствие изменения температуры. Равновесие подавляющего большинства химических реакций сдвигается при изменении температуры. Фактором, который определяет направление смещения равновесия, является при этом знак теплового эффекта реакции. Можно показать, что при повышении температуры равновесие смещается в направлении эндотермической, а при понижении - в направлении экзотермической реакции.
Так, синтез аммиака представляет собой экзотермическую реакцию
Поэтому при повышении температуры равновесие в системе сдвигается влево - в сторону разложения аммиака, так как этот процесс идет с поглощением теплоты.
Наоборот, синтез оксида азота (II) представляет собой эндотермическую реакцию:
Поэтому при повышении температуры равновесие в системе сдвигается вправо - в сторону образования .
Закономерности, которые проявляются в рассмотренных примерах нарушения химического равновесия, представляют собою частные случаи общего принципа, определяющего влияние различных факторов на равновесные системы. Этот принцип, известный под названием принципа Ле Шателье, в применении к химическим равновесиям можно сформулировать так:
Если на систему, находящуюся в равновесии, оказать какое-либо воздействие, то в результате протекающих в ней процессов равновесие сместится в таком направлении, что оказанное воздействие уменьшится.
Действительно, при введении в систему одного из веществ, участвующих в реакции, равновесие смещается в сторону расхода этого вещества. "При повышении давления оно смещается так, что давление в системе снижается; при повышении температуры равновесие смещается в сторону эндотермической реакции - температура в системе падает.
Принцип Ле Шателье распространяется не только на химические, но и на различные физико-химические равновесия. Смещение равновесия при изменении условий таких процессов, как кипение, кристаллизация, растьорение, происходит в соответствии с принципом Ле Шателье.
Функция
называется четной (нечетной), если для
любогои выполняется равенство
 .
.
График четной
функции симметричен относительно оси
 .
.
График нечетной функции симметричен относительно начала координат.
Пример 6.2. Исследовать на четность или нечетность функции
1)
 ;
2)
;
2) ;
3)
;
3) .
.
Решение .
1) Функция определена
при
 .
Найдем
.
Найдем .
.
Т.е.
 .
Значит, данная функция является четной.
.
Значит, данная функция является четной.
2) Функция определена
при

Т.е.
 .
Таким образом, данная функция нечетная.
.
Таким образом, данная функция нечетная.
3) функция определена для , т.е. для
 ,
,
 .
Поэтому функция не является ни четной,
ни нечетной. Назовем ее функцией общего
вида.
.
Поэтому функция не является ни четной,
ни нечетной. Назовем ее функцией общего
вида.
3. Исследование функции на монотонность.
Функция
 называется возрастающей (убывающей) на
некотором интервале, если в этом интервале
каждому большему значению аргумента
соответствует большее (меньшее) значение
функции.
называется возрастающей (убывающей) на
некотором интервале, если в этом интервале
каждому большему значению аргумента
соответствует большее (меньшее) значение
функции.
Функции возрастающие (убывающие) на некотором интервале называются монотонными.
Если функция
 дифференцируема на интервале
дифференцируема на интервале и имеет положительную (отрицательную)
производную
и имеет положительную (отрицательную)
производную ,
то функция
,
то функция возрастает (убывает) на этом интервале.
возрастает (убывает) на этом интервале.
Пример 6.3 . Найти интервалы монотонности функций
1)
 ;
3)
;
3) .
.
Решение .
1) Данная функция определена на всей числовой оси. Найдем производную .
Производная равна
нулю, если
 и
и .
Область определения – числовая ось,
разбивается точками
.
Область определения – числовая ось,
разбивается точками ,
, на интервалы. Определим знак производной
в каждом интервале.
на интервалы. Определим знак производной
в каждом интервале.

В интервале
 производная отрицательна, функция на
этом интервале убывает.
производная отрицательна, функция на
этом интервале убывает.
В интервале
 производная положительна, следовательно,
функция на этом интервале возрастает.
производная положительна, следовательно,
функция на этом интервале возрастает.
2) Данная функция
определена, если
 или
или
 .
.

Определяем знак квадратного трехчлена в каждом интервале.
Таким образом, область определения функции
Найдем производную
 ,
, ,
если
,
если ,
т.е.
,
т.е. ,
но
,
но .
Определим знак производной в интервалах
.
Определим знак производной в интервалах .
.

В интервале
 производная отрицательна, следовательно,
функция убывает на интервале
производная отрицательна, следовательно,
функция убывает на интервале .
В интервале
.
В интервале производная положительна, функция
возрастает на интервале
производная положительна, функция
возрастает на интервале .
.
4. Исследование функции на экстремум.
Точка
 называется точкой максимума (минимума)
функции
называется точкой максимума (минимума)
функции ,
если существует такая окрестность точки
,
если существует такая окрестность точки ,
что для всех
,
что для всех из этой окрестности выполняется
неравенство
из этой окрестности выполняется
неравенство
 .
.
Точки максимума и минимума функции называются точками экстремума.
Если функция
 в точке
в точке имеет экстремум, то производная функции
в этой точке равна нулю или не существует
(необходимое условие существования
экстремума).
имеет экстремум, то производная функции
в этой точке равна нулю или не существует
(необходимое условие существования
экстремума).
Точки, в которых производная равна нулю или не существует называются критическими.
5. Достаточные условия существования экстремума.
Правило 1
.
Если при переходе (слева направо) через
критическую точку
 производная
производная меняет знак с «+» на «–», то в точке
меняет знак с «+» на «–», то в точке функция
функция имеет максимум; если с «–» на «+», то
минимум; если
имеет максимум; если с «–» на «+», то
минимум; если не меняет знак, то экстремума нет.
не меняет знак, то экстремума нет.
Правило 2
.
Пусть в точке
 первая производная функции
первая производная функции равна нулю
равна нулю ,
а вторая производная существует и
отлична от нуля. Если
,
а вторая производная существует и
отлична от нуля. Если ,
то
,
то – точка максимума, если
– точка максимума, если ,
то
,
то – точка минимума функции.
– точка минимума функции.
Пример 6.4 . Исследовать на максимум и минимум функции:
1)
 ;
2)
;
2) ;
3)
;
3) ;
;
4)
 .
.
Решение.
1) Функция определена
и непрерывна на интервале
 .
.
Найдем производную
 и решим уравнение
и решим уравнение ,
т.е.
,
т.е. .Отсюда
.Отсюда – критические точки.
– критические точки.
Определим знак
производной в интервалах
, .
.

При переходе через
точки
 и
и производная меняет знак с «–» на «+»,
поэтому по правилу 1
производная меняет знак с «–» на «+»,
поэтому по правилу 1 – точки минимума.
– точки минимума.
При переходе через
точку
 производная меняет знак с «+» на «–»,
поэтому
производная меняет знак с «+» на «–»,
поэтому – точка максимума.
– точка максимума.
 ,
,
 .
.
2) Функция определена
и непрерывна в интервале
 .
Найдем производную
.
Найдем производную .
.
Решив уравнение
 ,
найдем
,
найдем и
и – критические точки. Если знаменатель
– критические точки. Если знаменатель ,
т.е.
,
т.е. ,
то производная не существует. Итак,
,
то производная не существует. Итак, – третья критическая точка. Определим
знак производной в интервалах.
– третья критическая точка. Определим
знак производной в интервалах.

Следовательно,
функция имеет минимум в точке
 ,
максимум в точках
,
максимум в точках и
и .
.
3) Функция определена
и непрерывна, если
 ,
т.е. при
,
т.е. при .
.
Найдем производную

 .
.
Найдем критические
точки:


Окрестности точек
 не принадлежат области определения,
поэтому они не являются т. экстремума.
Итак, исследуем критические точки
не принадлежат области определения,
поэтому они не являются т. экстремума.
Итак, исследуем критические точки и
и .
.

4) Функция определена
и непрерывна на интервале
 .
Используем правило 2. Найдем производную
.
Используем правило 2. Найдем производную .
.
Найдем критические точки:
Найдем вторую
производную
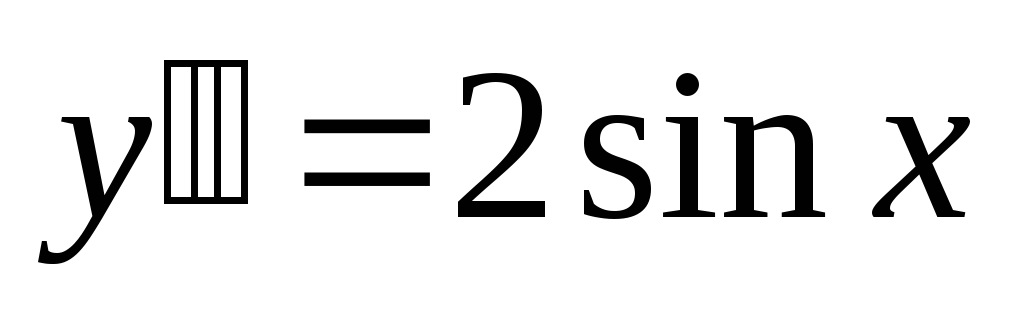 и определим ее знак в точках
и определим ее знак в точках
В точках
 функция имеет минимум.
функция имеет минимум.
В точках
 функция имеет максимум.
функция имеет максимум.
Нули функции
Нулём функции называется то значение х
, при котором функция обращается в 0, то есть f(x)=0.
Нули – это точки пересечения графика функции с осью Ох.
Четность функции
Функция называется чётной, если для любого х
из области определения выполняется равенство f(-x) = f(x)

Четная функция симметрична относительно оси Оу
Нечетность функции
Функция называется нечётной, если для любого х
из области определения выполняется равенство f(-x) = -f(x).

Нечетная функция симметрична относительно начала координат.
Функция которая не является ни чётной,ни нечётной называется функцией общего вида.

Возрастание функции
Функция f(x) называется возрастающей, если большему значению аргумента соответствует большее значение функции, т.е. 
Убывание функции
Функция f(x) называется убывающей, если большему значению аргумента соответствует меньшее значение функции, т.е. 
Промежутки, на которых функция либо только убывает, либо только возрастает, называются промежутками монотонности
. Функция f(x) имеет 3 промежутка монотонности:

Находят промежутки монотонности с помощью сервиса Интервалы возрастания и убывания функции
Локальный максимум
Точка х 0
называется точкой локального максимума, если для любого х
из окрестности точки х 0
выполняется неравенство: f(x 0) > f(x)

Локальный минимум
Точка х 0
называется точкой локального минимума, если для любого х
из окрестности точки х 0
выполняется неравенство: f(x 0) < f(x).

Точки локального максимума и точки локального минимума называются точками локального экстремума.

точки локального экстремума.
Периодичность функции
Функция f(x) называется периодичной, с периодом Т
, если для любого х
выполняется равенство f(x+T) = f(x) .

Промежутки знакопостоянства
Промежутки, на которых функция либо только положительна, либо только отрицательна, называются промежутками знакопостоянства.

Непрерывность функции
Функция f(x) называется непрерывной в точке x 0 , если предел функции при x → x 0 равен значению функции в этой точке, т.е. ![]() .
.

Точки разрыва
Точки, в которых нарушено условие непрерывности называются точками разрыва функции.

x 0
- точка разрыва.
Общая схема для построения графиков функций
1. Найти область определения функции D(y).
2. Найти точки пересечения графика функций с осями координат.
3. Исследовать функцию на четность или нечетность.
4. Исследовать функцию на периодичность.
5. Найти промежутки монотонности и точки экстремума функции.
6. Найти промежутки выпуклости и точки перегиба функции.
7. Найти асимптоты функции.
8. По результатам исследования построить график.
Пример: Исследовать функцию и построить ее график: y = x 3 – 3x
1) Функция определена на всей числовой оси, т. е. ее область определения D(y) = (-∞; +∞).
2) Найдем точки пересечения с осями координат:
с осью ОХ: решим уравнение x 3 – 3x = 0
с осью ОY: y(0) = 0 3 – 3*0 = 0
3) Выясним, не является ли функция четной или нечетной:
y(-x) = (-x) 3 – 3(-x) = -x 3 + 3x = - (x 3 – 3x) = -y(x)
Отсюда следует, что функция является нечетной.
4) Функция непериодична.
5) Найдем промежутки монотонности и точки экстремума функции: y’ = 3x 2 - 3.
Критические точки: 3x 2 – 3 = 0, x 2 =1, x= ±1.

y(-1) = (-1) 3 – 3(-1) = 2
y(1) = 1 3 – 3*1 = -2
6) Найдем промежутки выпуклости и точки перегиба функции: y’’ = 6x
Критические точки: 6x = 0, x = 0.

y(0) = 0 3 – 3*0 = 0
7) Функция непрерывна, асимптот у нее нет.
8) По результатам исследования построим график функции.
